Ihtisar
Idéntifikasi gancang tutuwuhan transgenik
Téks/Tong Yucheng
Operasi ékspérimén / Han Ying
Editor/Wen Youjun
Kecap / 1600+
Disarankeun waktos maca / 8-10 menit
Idéntifikasi gancang tutuwuhan transgenik
Salaku pendatang di laboratorium, éta sanés padamelan anu saé pikeun nyaring pepelakan positip tina sakumpulan pepelakan kalayan tingkat konversi anu rendah.Kahiji, DNA kudu sasari tina sajumlah badag sampel hiji-hiji, lajeng gén asing bakal dideteksi ku PCR.Sanajan kitu, hasilna mindeng blanks jeung band kalawan sababaraha item kalana, tapi mustahil pikeun nangtukeun naha aya deteksi lasut atawa deteksi palsu..Naha teu daya teu upaya pikeun nyanghareupan prosés sareng hasil ékspérimén sapertos kitu?Tong hariwang, lanceuk ngajarkeun anjeun kumaha carana nyaring pepelakan positip transgenik kalayan gampang sareng akurat.
Lengkah 1: Primer deteksi desain
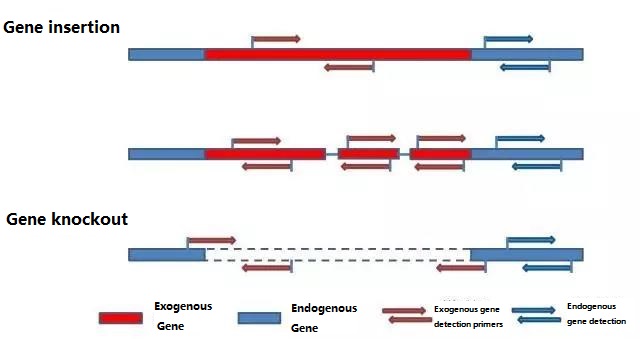
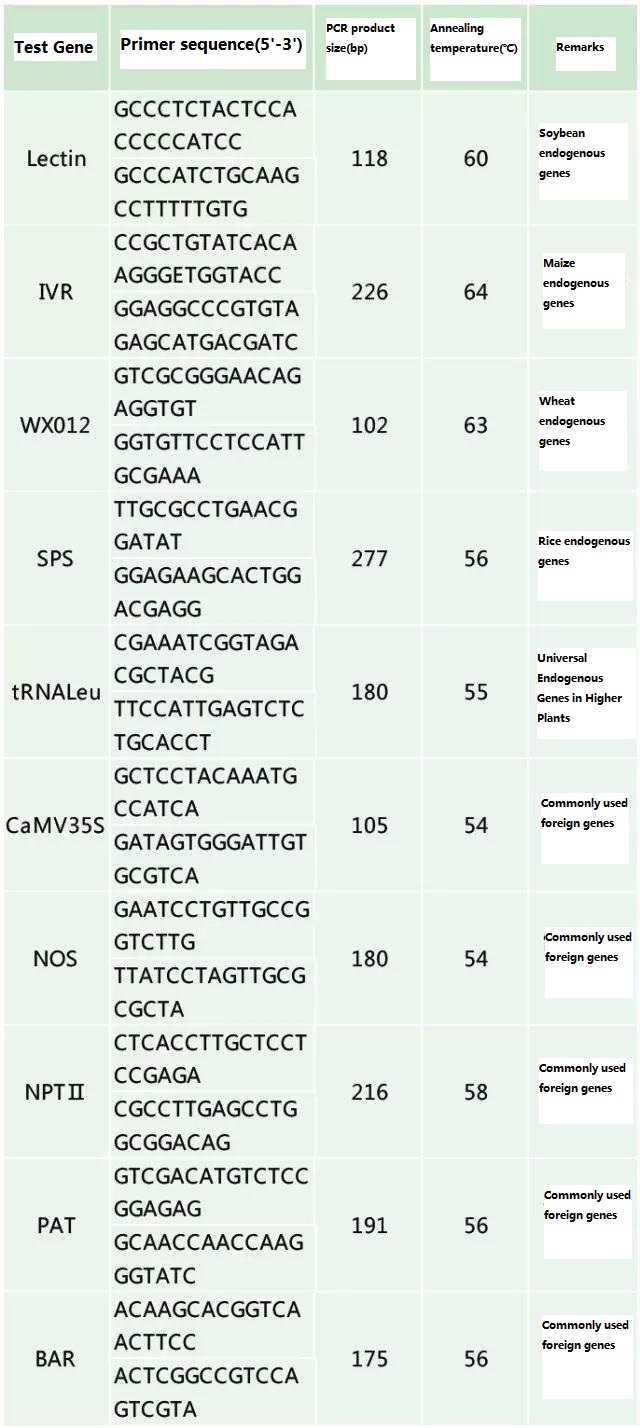
Nangtukeun gén endogenous jeung gén exogenous nu bakal dideteksi nurutkeun sampel bakal diuji, tur pilih runtuyan 100-500bp wawakil dina gén keur desain primér.Primer alus bisa mastikeun akurasi hasil deteksi jeung shorten waktu deteksi (tingali lampiran pikeun primers deteksi ilahar dipaké).
Catetan:
Primer anu nembé dirarancang kedah ngaoptimalkeun kaayaan réaksi sareng pariksa akurasi, presisi, sareng wates deteksi deteksi sateuacan ngalakukeun deteksi skala ageung.
Lengkah 2:Ngembangkeun protokol ékspérimén

Kontrol positif: Paké DNA dimurnikeun ngandung fragmen target salaku citakan pikeun nangtukeun naha sistem réaksi PCR jeung kaayaan normal.
kontrol négatip / kosong: Paké template DNA atawa ddH2O nu teu ngandung fragmen target salaku citakan pikeun ngadeteksi naha aya sumber kontaminasi dina sistem PCR.
Kontrol rujukan internal: make kombinasi primer / usik tina gén endogenous sampel pikeun diuji pikeun evaluate naha citakan bisa dideteksi ku PCR.
Catetan:
Positip, négatif/kosong kontrol jeung kontrol kontrol internal kudu diatur pikeun tiap tés pikeun evaluate validitas hasil eksperimen.
Lengkah 3: Persiapan ékspérimén

Sateuacan dianggo, perhatikeun naha solusina dicampur rata.Upami aya présipitasi, éta kedah leyur sareng dicampur dumasar kana petunjuk sateuacan dianggo.2×PCR campuran perlu pipetted jeung dicampur sababaraha kali jeung micropipette saméméh dipaké pikeun nyingkahan distribusi ion henteu rata.
Catetan:
Candak kaluar parentah jeung maca eta taliti, sarta nyieun olahan saméméh percobaan luyu ketat jeung parentah.
Lengkah 4: Nyiapkeun sistem réaksi PCR
Numutkeun protokol eksperimen, campur primers, H2O, 2×PCR campuran, centrifuge jeung ngadistribusikaeun ka unggal tube réaksi.
Catetan:
Pikeun uji skala ageung atanapi jangka panjang, disarankeun ngagunakeun sistem réaksi PCR anu ngandung énzim UNG, anu sacara efektif tiasa nyegah kontaminasi aerosol anu disababkeun ku produk PCR.
Lengkah 5: Tambahkeun template réaksi

Ngagunakeun téhnologi Direct PCR, teu perlu prosés purifikasi asam nukléat tedious.Citakan sampel bisa disiapkeun dina 10 menit sarta ditambahkeun kana sistem réaksi PCR pakait.
Catetan:
Metodeu Lysis gaduh pangaruh deteksi anu langkung saé, sareng produk anu dicandak tiasa dianggo pikeun sababaraha réaksi deteksi.
5.1: PCR langsung daun
Numutkeun ukuran gambar dina manual, potong jaringan daun kalayan diaméter 2-3mm sareng nempatkeun kana sistem réaksi PCR.
Catetan: Pastikeun yén fragmen daun sagemblengna immersed dina solusi réaksi PCR, sarta ulah nambahkeun jaringan daun kaleuleuwihan.
5.2: Métode lisis daun
Potong jaringan daun kalayan diaméter 5-7mm sareng nempatkeun kana tabung centrifuge.Upami anjeun milih daun asak, punten ulah nganggo jaringan urat utama daun.Pipet 50ul panyangga P1 lysate kana tube centrifuge pikeun mastikeun yén lysate nu lengkep bisa neuleumkeun jaringan daun, nempatkeun eta dina cycler termal atawa mandi logam, sarta lyse dina 95 ° C pikeun 5-10 menit.


Tambahkeun 50ul Buffer P2 solusi nétralisasi jeung mix ogé.Lysate hasilna bisa dipaké salaku citakan sarta ditambahkeun kana sistem réaksi PCR.
Catetan: Jumlah template kedah antara 5-10% tina sistem PCR, sarta teu kudu ngaleuwihan 20% (contona, dina sistem PCR 20μl, tambahkeun 1-2μl lysis panyangga, teu leuwih ti 4μl).
Lengkah 6: Réaksi PCR

Saatos centrifuging tabung réaksi PCR, nempatkeun aranjeunna dina alat PCR pikeun amplifikasi.
Catetan:
Réaksina ngagunakeun citakan anu henteu dimurnikeun pikeun amplifikasi, sahingga jumlah siklus amplifikasi 5-10 siklus langkung seueur tibatan nalika ngagunakeun citakan DNA anu dimurnikeun.
Lengkah 7: Deteksi éléktroforésis sareng analisa hasil

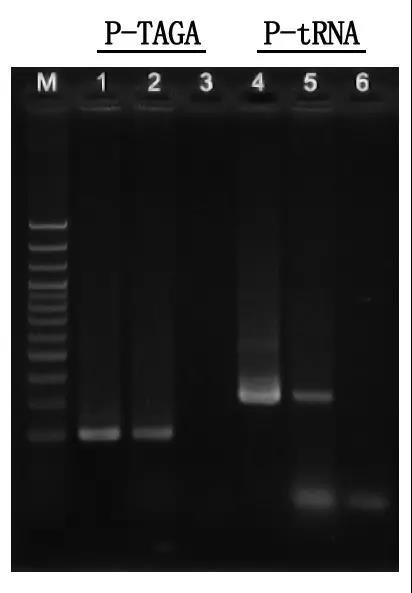
M: 100bp DNA Tangga
1\4: Métode DNA dimurnikeun
2\5: Métode PCR langsung
3\6: Kadali kosong
Kontrol kualitas:
Hasil tés tina sagala rupa kadali anu disetél dina percobaan kedah nyumponan kaayaan di handap ieu.Upami teu kitu, anu nyababkeun masalah kedah dianalisis, sareng tés kedah dilakukeun deui saatos masalahna dileungitkeun.
Tabél 1. Hasil tés normal tina sababaraha kelompok kontrol

* Nalika plasmid dipaké salaku kontrol positif, hasil tés gén endogenous bisa négatip
Hasil kaputusan:
A. Hasil tés gén endogenous sampel négatip, nunjukkeun yén DNA cocog pikeun deteksi PCR biasa teu bisa sasari tina sampel atawa DNA sasari ngandung sambetan réaksi PCR, sarta DNA kudu sasari deui.
B. Hasil uji tina gén endogenous sampel positif, sarta hasil tés gén exogenous négatip, nunjukkeun yén DNA cocog pikeun deteksi PCR biasa ieu sasari tina sampel, sarta eta bisa judged yén gén XXX teu kauninga dina sampel.
C. Hasil tés tina gén endogenous sampel positif, sarta hasil tés gén exogenous positif, nunjukkeun yén DNA cocog pikeun deteksi PCR biasa geus sasari tina sampel, sarta sampel DNA ngandung gén XXX.Ékspérimén konfirmasi tiasa dilaksanakeun salajengna.
Hambalan 8: Desain primér deteksi

Sanggeus ékspérimén, anggo 2% larutan natrium hipoklorit sareng 70% larutan étanol pikeun ngusap daérah ékspérimén pikeun nyegah polusi lingkungan.
lampiran
meja 2. Primes ilahar dipaké pikeun deteksi PCR umum tutuwuhan dirobah genetik
Dokumén rujukan:
SN / T 1202-2010, Metoda deteksi PCR kualitatif pikeun bahan tutuwuhan dirobah genetik dina dahareun.
Kamentrian Pertanian Pengumuman 1485-5-2010, Nguji bahan tutuwuhan dirobah genetik jeung produk maranéhanana-béas M12 jeung turunan na.
waktos pos: Jun-09-2021








