Antibodi, disebut oge immunoglobulins (Ig), mangrupakeun glikoprotein nu husus ngabeungkeut antigén.
Persiapan antibodi konvensional dihasilkeun ku immunizing sato jeung ngumpulkeun antiserum.Ku alatan éta, antisérum biasana ngandung antibodi ngalawan antigén séjén nu teu patali jeung komponén protéin lianna dina sérum.Molekul antigén umum lolobana ngandung sababaraha épitop béda, jadi antibodi konvensional ogé mangrupa campuran antibodi ngalawan sababaraha épitop béda.Malah antibodi sérum konvensional diarahkeun ngalawan epitope sarua masih diwangun ku antibodi hétérogén dihasilkeun ku klon sél B béda.Ku alatan éta, antibodi sérum konvensional disebut oge antibodi polyclonal, atawa antibodi polyclonal pikeun pondok.
Antibodi monoklonal (antibodi monoklonal) nyaéta antibodi anu saragam pisan dihasilkeun ku klon sél B tunggal jeung ngan diarahkeun kana épitop husus.Biasana disusun ku téknologi hibridoma—téknologi antibodi hibridoma dumasar kana téknologi fusi sél, ngagabungkeun sél B kalawan kamampuhan pikeun ngasékrésikeun antibodi husus sarta sél myeloma kalawan kapasitas tumuwuh tanpa wates kana hibridomas-sél B.Sél hibridoma ieu mibanda ciri-ciri sél induk.Bisa proliferate salamina tur abadi in vitro kawas sél myeloma, sarta eta bisa nyintésis jeung secrete antibodi husus kawas limfosit splenic.Ngaliwatan kloning, garis monoklonal diturunkeun tina sél hibridoma tunggal, nyaéta, garis sél hibridoma, tiasa didapet.Antibodi anu dihasilkeun nyaéta antibodi anu homogen pisan ngalawan determinan antigen anu sami, nyaéta, antibodi monoklonal.
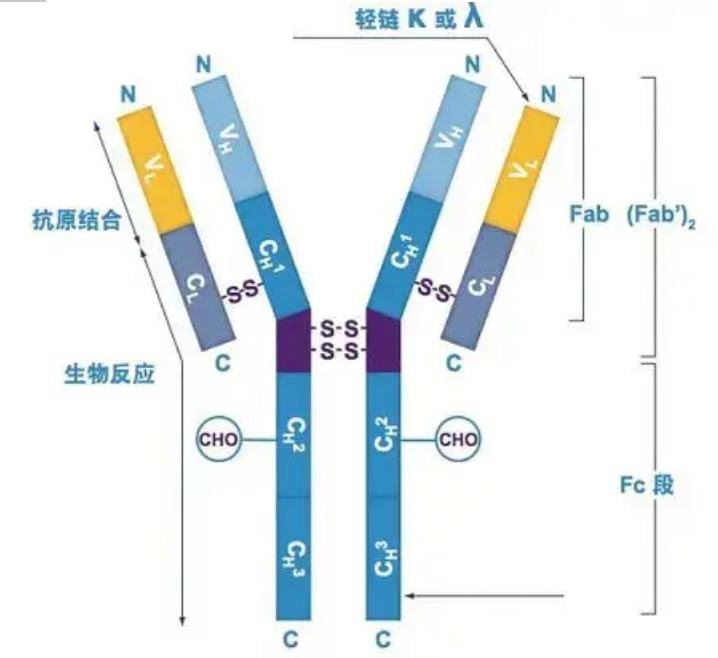
Antibodi aya salaku hiji atawa leuwih monomér ngawangun Y (ie, antibodi monoklonal atawa antibodi poliklonal).Unggal monomér ngawangun Y diwangun ku 4 ranté polipéptida, kaasup dua ranté beurat idéntik jeung dua ranté lampu idéntik.Ranté ringan sareng ranté beurat dingaranan dumasar kana beurat molekulna.Luhureun struktur ngawangun Y nyaéta wewengkon variabel, nu mangrupakeun situs beungkeutan antigen.(Kutipan tina Konsep Antibodi Bio-Monoklonal Detai)
Struktur antibodi
 Ranté beurat
Ranté beurat
Aya lima jinis ranté beurat mamalia Ig, dingaranan ku hurup Yunani α, δ, ε, γ, jeung μ.Antibodi anu pakait disebut IgA, IgD, IgE, IgG, sareng IgM.Ranté beurat anu béda-béda béda dina ukuran sareng komposisi.α jeung γ ngandung kira-kira 450 asam amino, sedengkeun μ jeung ε ngandung kira-kira 550 asam amino.
Unggal ranté beurat boga dua wewengkon: wewengkon konstanta sarta wewengkon variabel.Kabéh antibodi tina tipe sarua boga wewengkon konstan sarua, tapi aya béda antara antibodi tipe béda.Wewengkon konstan tina ranté beurat γ, α, jeung δ diwangun ku tilu domain Ig dina tandem, kalawan wewengkon hinge pikeun ngaronjatkeun kalenturan na;wewengkon konstan tina ranté beurat μ jeung ε diwangun ku 4 domain Ig.Wewengkon variabel ranté beurat antibodi anu dihasilkeun ku sél B béda béda, tapi daérah variabel antibodi anu diproduksi ku sél B atanapi klon sél anu sami sami, sareng daérah variabel unggal ranté beurat panjangna sakitar 110 asam amino., Sareng ngabentuk domain Ig tunggal.
Ranté lampu
Aya ngan dua jenis ranté lampu dina mamalia: tipe lambda jeung tipe kappa.Unggal ranté lampu boga dua domain numbu: wewengkon konstanta sarta wewengkon variabel.Panjang ranté cahaya nyaéta ngeunaan 211 ~ 217 asam amino.Dua ranté cahaya anu aya dina unggal antibodi sok sami.Pikeun mamalia, ranté cahaya dina unggal antibodi ngan boga hiji tipe: kappa atawa lambda.Dina sababaraha vertebrata handap, kayaning lauk cartilaginous (lauk kartilage) jeung lauk bony, tipe séjén ranté lampu kayaning tipe iota (iota) ogé kapanggih.
Bagéan Fab sareng Fc
Bagéan Fc tiasa langsung digabungkeun sareng énzim atanapi pewarna fluoresensi pikeun labél antibodi.Éta mangrupikeun bagian dimana antibodi rivets dina piring nalika prosés ELISA, sareng éta ogé bagian dimana antibodi kadua dikenal sareng dibeungkeut dina immunoprecipitation, immunoblotting sareng immunohistochemistry.Antibodi bisa dihidrolisis jadi dua ruas F(ab) jeung hiji ruas Fc ku énzim proteolitik saperti papain, atawa bisa peupeus ti wewengkon hinge ku pépsin jeung dihidrolisis jadi hiji ruas F(ab)2 jeung hiji ruas Fc.fragmen antibodi IgG kadang pohara kapaké.Alatan kurangna bagéan Fc, bagéan F(ab) moal endapanan jeung antigén, atawa bakal katangkep ku sél imun dina studi in vivo.Kusabab fragmen molekular leutik sareng kurangna fungsi cross-linking (kusabab kurangna bagean Fc), ruas Fab biasana dianggo pikeun radiolabeling dina studi fungsional, sareng bagean Fc utamina dianggo salaku agén blocking dina pewarnaan histokimia.
Wewengkon variabel sareng konstan
Wewengkon variabel (wewengkon V) ayana dina 1/5 atawa 1/4 (ngandung kira-kira 118 résidu asam amino) tina ranté H deukeut N-terminus jeung 1/2 (ngandung ngeunaan 108-111 résidu asam amino) deukeut N-terminus ranté L .Unggal wewengkon V miboga cingcin péptida anu dibentuk ku beungkeut disulfida intra-ranté, sarta unggal cingcin péptida ngandung kira-kira 67 nepi ka 75 résidu asam amino.Komposisi jeung susunan asam amino di wewengkon V nangtukeun spésifisitas antigen ngariung antibodi.Alatan jenis sarta runtuyan asam amino nu kantos-ngarobah di wewengkon V, rupa-rupa antibodi jeung spésifisitas antigen ngariung béda bisa kabentuk.Wewengkon V tina ranté L jeung ranté H disebut VL jeung VH, masing-masing.Dina VL jeung VH, komposisi asam amino jeung runtuyan sababaraha wewengkon lokal boga darajat variasi luhur.Wewengkon ieu disebut wewengkon hypervariable (HVR).Komposisi asam amino jeung susunan bagian non-HVR di wewengkon V relatif konservatif, nu disebut wewengkon kerangka.Aya tilu daérah hypervariable dina VL, biasana aya dina résidu asam amino masing-masing 24 dugi ka 34 sareng 89 dugi ka 97.Tilu HVR VL sareng VH disebut HVR1, HVR2 sareng HVR3 masing-masing.Panaliti sareng analisa difraksi kristal sinar-X ngabuktikeun yén daérah hypervariable memang tempat ngiket antigen antibodi, ku kituna disebut daérah penentu komplementaritas (CDR).HVR1, HVR2 sareng HVR3 tina VL sareng VH tiasa disebat CDR1, CDR2 sareng CDR3 masing-masing.Sacara umum, CDR3 ngagaduhan tingkat hipervariabilitas anu langkung luhur.Wewengkon hypervariable ogé lokasi utama dimana determinants idiotypic molekul Ig aya.Dina kalolobaan kasus, ranté H muterkeun hiji peran leuwih penting dina ngariung ka antigén.
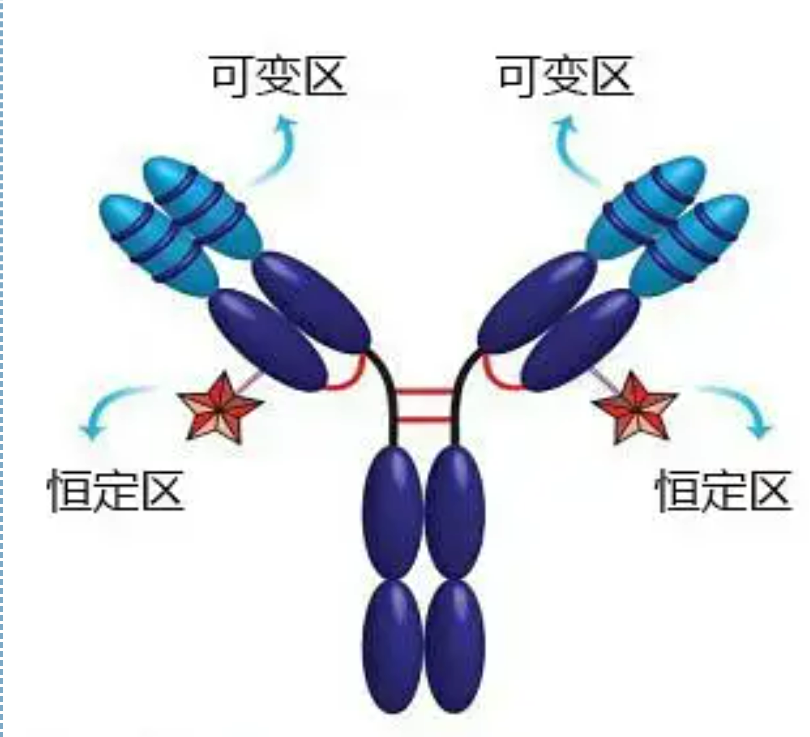 Wewengkon konstan (wewengkon C)perenahna di 3/4 atawa 4/5 (kira-kira tina asam amino 119 nepi ka terminal C) tina ranté H deukeut terminal C jeung 1/2 (ngandung ngeunaan 105 résidu asam amino) deukeut terminal C tina ranté L.Unggal wewengkon fungsional ranté H ngandung kira 110 résidu asam amino, sarta ngandung cingcin péptida diwangun ku 50-60 résidu asam amino disambungkeun ku beungkeut disulfida.Komposisi sareng susunan asam amino di daérah ieu rélatif konstan dina ranté Ig isotype L sato sareng ranté H anu sami.Sarua, éta ngan ukur tiasa ngabeungkeut antigen anu saluyu, tapi struktur daérah C na sami, nyaéta, éta gaduh antigen anu sami.Kuda anti-manusa IgG antibodi sékundér (atawa anti-antibodi) bisa digabungkeun jeung dua A kombinasi antibodi (IgG) ngalawan exotoxins béda lumangsung.Ieu mangrupikeun dasar anu penting pikeun nyiapkeun antibodi sekundér sareng nerapkeun fluorescein, isotop, énzim sareng antibodi anu dilabélan sanés.
Wewengkon konstan (wewengkon C)perenahna di 3/4 atawa 4/5 (kira-kira tina asam amino 119 nepi ka terminal C) tina ranté H deukeut terminal C jeung 1/2 (ngandung ngeunaan 105 résidu asam amino) deukeut terminal C tina ranté L.Unggal wewengkon fungsional ranté H ngandung kira 110 résidu asam amino, sarta ngandung cingcin péptida diwangun ku 50-60 résidu asam amino disambungkeun ku beungkeut disulfida.Komposisi sareng susunan asam amino di daérah ieu rélatif konstan dina ranté Ig isotype L sato sareng ranté H anu sami.Sarua, éta ngan ukur tiasa ngabeungkeut antigen anu saluyu, tapi struktur daérah C na sami, nyaéta, éta gaduh antigen anu sami.Kuda anti-manusa IgG antibodi sékundér (atawa anti-antibodi) bisa digabungkeun jeung dua A kombinasi antibodi (IgG) ngalawan exotoxins béda lumangsung.Ieu mangrupikeun dasar anu penting pikeun nyiapkeun antibodi sekundér sareng nerapkeun fluorescein, isotop, énzim sareng antibodi anu dilabélan sanés.
Produk patali:
Sél langsung RT-qPCR kit
waktos pos: Sep-30-2021








